无标记阻抗免疫传感器,用于新冠病毒抗体即时检测
2023-01-07 21:04:57 来源:麦姆斯咨询 评论:0 点击:
新型冠状病毒肺炎(COVID-19)是由国际病毒分类委员会指定的“严重急性呼吸系统综合征冠状病毒2型”病毒(SARS-CoV-2)引起的。由于这种病毒具有高度传染性,可导致严重的呼吸道疾病,进而引起死亡,世界卫生组织(WHO)于2020年3月11日将COVID-19疫情列为大流行。在大流行中,提供快速、准确和便捷的诊断方法来检测感染和监测免疫反应,对于治疗、减轻、控制和管理疾病的传播至关重要。
目前,用于检测和监测SARS-CoV-2感染的主要实验室诊断工具可分为以下几类:(1)识别病毒RNA的工具;(2)检测病毒抗原的工具;(3)检测病毒感染时体液反应中产生的抗体的工具。其中,利用实时逆转录聚合酶链反应(RT-PCR)检测病毒RNA是诊断活动性感染的金标准。然而,该技术容易受到样本处理问题和病毒突变的影响,从而可能分别导致假阳性和假阴性的检测结果。而抗原检测是通过对病毒中存在的蛋白质(如N和S蛋白)进行免疫检测,以确定活动性感染。基于侧向流动检测的快速抗原检测因具有易于使用、价格低廉、可在5-30分钟内提供检测结果的优势,已成为COVID-19即时诊断的代名词。然而,与RT-PCR相比,快速抗原检测的灵敏度较低。
与以上两种方法对应,抗体或血清学检测方法用于检测人体内是否存在SARS-CoV-2抗体。由于抗体是由免疫系统的B细胞对病毒感染做出反应而产生的,阳性的血清学检测结果表明人体在过去或当下受到了病毒感染。此外,这些检测可以帮助减少假阳性和假阴性检测结果的数量,是病毒RNA和病毒抗原检测的重要补充。事实上,血清学检测相比病毒RNA和抗原检测有一些优势,比如检测窗口更长;并且与病毒RNA相比,人体抗体更稳定;另外,采集血液比采集呼吸道样本更安全;同时,血液中的抗体比呼吸道样本中的病毒分布更均匀;且血清学检测不需要在生物安全二级(BSL-2)实验室进行。此外,抗体检测在诊断涉及病毒RNA检测阴性或无症状感染的疑似病例以及在群体水平进行接触者追踪、疫情发展监测、病毒来源追踪和流行病学评估等方面发挥着重要作用;这些检测还在监测免疫反应以评估免疫的进程、程度和持久性,确定处于康复期的潜在献血人员,开发和评估治疗性抗体,以及开发和评估疫苗方面发挥作用。
据麦姆斯咨询报道,近期,来自加拿大阿尔伯塔大学(University of Alberta)的研究人员于Microsystems & Nanoengineering期刊发表了题为“Label-free impedimetric immunosensor for point-of-care detection of COVID-19 antibodies”的论文,提出了一种基于叉指微电极阵列(IMA)的阻抗免疫传感器,用于检测和监测人体血清中的SARS-CoV-2抗体。该传感器利用化学偶联反应将SARS-CoV-2的刺突蛋白(S蛋白)功能化并共价固定在IMA表面,作为识别层,以特异性结合抗刺突抗体。而抗体与识别层S蛋白的结合将导致电容增加,从而引起传感系统阻抗的变化。
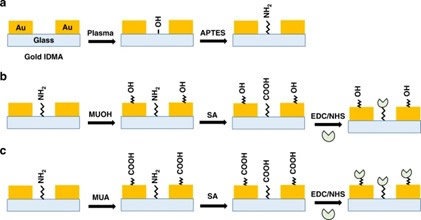
图1 叉指微电极阵列(IMA)表面功能化和刺突蛋白固定化示意图
其中,该基于电化学阻抗谱(EIS)的生物传感器中的检测信号可以来自法拉第过程或非法拉第过程。在基于法拉第过程的生物传感器中,由于系统中氧化还原试剂的氧化还原反应,检测信号来自IMA上的界面电荷转移反应。在这个过程中,氧化还原试剂是必需的,同时传感系统中的输入电压必须高于氧化还原试剂的氧化还原电位。而基于非法拉第过程的生物传感器的检测信号来自于IMA电极-溶液界面识别层中选择性抗原-抗体结合导致的界面层电容和电阻的变化。因此,基于非法拉第过程的传感系统是无标记的,需要低无扰动电压,因而适用于即时诊断(POC)应用。
基于非法拉第过程传感系统的检测原理如图1所示,当IMA中的电极和电极间隙分别被巯基-十一醇(MUOH)和氨丙基三乙氧基硅烷(APTES)功能化时,斯特恩(Stern)层和扩散层通过形成自组装单分子层(SAM)而被推离电极表面。SAM的进一步功能化和随后的刺突蛋白固定化导致识别层的形成,这使得传感器能够选择性地结合和检测COVID-19抗体。
众所周知,电容式生物传感器的灵敏度低于法拉第式生物传感器。提高电容式生物传感器灵敏度的一个巧妙方法是降低EIS测量中使用的溶液的离子强度。为了深入了解离子强度对器件灵敏度的影响,研究人员以检测抗S蛋白抗体(IgG、IgM和IGA)为例,利用MUOH和APTES修饰的IMA,通过测量含有1 x PBS和0.001 x PBS的溶液中的阻抗来研究器件的性能。结果表明,当在1 x PBS溶液中进行阻抗测量时,该器件表现出相对较低的灵敏度;而在0.001 x PBS溶液中测得的低频区检测信号的幅值远大于在1 x PBS溶液中测得的相应值。显然,该结果表明,通过调节介质的离子强度,可以显著提高阻抗免疫传感器的灵敏度,这与理论上预测的电场的距离依赖性一致。
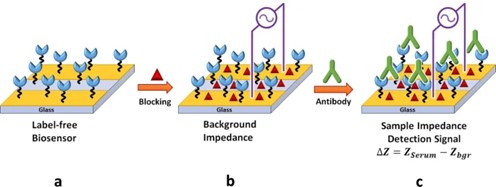
图2 无标记生物传感器对抗体与固定在阻抗免疫传感器识别层上的三聚体刺突蛋白选择性结合过程进行基于非法拉第过程的EIS测量示意图
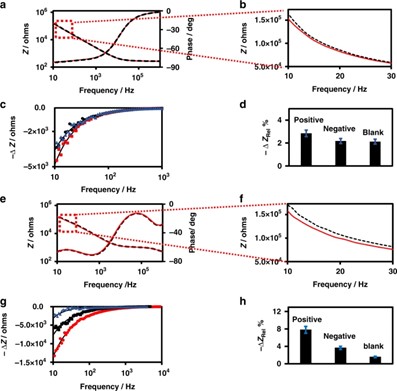
图3 生物传感器灵敏度对用于非法拉第过程EIS测量的传感介质离子强度的依赖关系
此外,根据利用世界卫生组织国际标准(WHO IS)制定的用于抗新冠病毒免疫球蛋白检测的标准曲线测定的结果,该器件的检测限(LOD)为0.4 BAU/ml,该LOD与所有已验证和已建立的商业检测报告的相应LOD(范围为0.41 ~ 4.81 BAU/ml)相似。另外,这种概念验证型生物传感器已被证明可以在1小时内检测到COVID-19感染者血清中的抗刺突抗体。
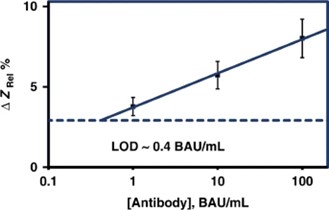
图4 无标记非法拉第EIS生物传感器检测新冠病毒抗体的标准校准曲线及其与其他生物传感器的性能比较
综上所述,在这项工作中,研究人员开发了一种无标记阻抗电容式免疫传感器,该传感器能够清晰地区分COVID-19阳性和COVID-19阴性的人血清样本,具有良好的灵敏度和特异性。该文介绍的非法拉第阻抗检测采用低无扰动电压,不需要标记或添加传感试剂,与ELISA不同,该方法不需要酶标记的二抗、底物以及相应的孵育时间。因此,无标记阻抗免疫传感器本质上需要比ELISA更短的孵育时间,未来有望用于快速诊断检测。
论文链接:https://doi.org/10.1038/s41378-022-00460-5
延伸阅读:
上一篇:综述:同时进行神经记录和调制的多功能探针的最新进展
下一篇:最后一页
